Sobald das Dossier eingereicht ist, löst es automatisch eine Inspektion durch die EU-Behörde aus. So kann das herstellende Unternehmen professionelle Beratung in Anspruch nehmen, um EU-GMP-konform zu werden. Das beratende Unternehmen arbeitet bei dem Vorhaben, ein EU-konformes Produkt zu verkaufen, mit dem Hersteller zusammen. Es kann ein Audit durchgeführt werden, das es dem Produktionsbetrieb ermöglicht, seine Prüfbereitschaft zu beurteilen. Dieses Audit kann als internes Audit genutzt werden, um die gesamte Dokumentation, die Prozesse und die Umsetzung der Grundsätze der Guten Herstellungspraxis zu überprüfen und Lücken im System zu identifizieren. Die Beratungsdienstleister können dem Produktionsbetrieb auch beim Aufbau und/oder bei der Aktualisierung seines Qualitätsmanagementsystems helfen. Sobald dies geschehen ist, gilt das System als EU-GMP-konform, und die Behörden werden die Fortschritte des Unternehmens anerkennen und das EU-GMP-Zertifikat ausstellen. Wenn dieses Zertifikat ausgestellt ist, hat der Produktionsbetrieb denselben Status wie ein EU-Produktionsbetrieb.
Da der Betrieb nun EU-GMP-zertifiziert ist, kann das Produkt vom Produktionsbetrieb hergestellt, geprüft und freigegeben werden. Trotz der Freigabe des Produkts in einem Produktionsbetrieb außerhalb der EU muss es auch in der EU freigegeben werden. Daher wird eine repräsentative Probe zur erneuten Prüfung und Freigabe an ein Labor in der EU geschickt. Sobald die Prüfung durch das Labor abgeschlossen ist, die Ergebnisse zufriedenstellend sind und mit den Ergebnissen des Nicht-EU-Produktionsbetriebs übereinstimmen, kann die Charge zusammen mit dem Analysezertifikat durch das Prüflabor freigegeben werden. Das Analysezertifikat enthält alle Spezifikationen für das Produkt sowie die erzielten Ergebnisse.
Wenn das Analysezertifikat vorliegt, wird ein Chargenfreigabezertifikat ausgestellt. Dieses Chargenfreigabezertifikat muss ausgestellt werden, bevor das Produkt in die Lieferkette gelangt, und dient zur Beantragung des Zertifikats eines pharmazeutischen Produkts bei den jeweiligen Gesundheitsbehörden. Diese Bescheinigung wird vom einführenden Land verlangt, um das Produkt in diesem Land registrieren und vertreiben zu können. Sobald dies alles abgeschlossen ist, kann das herstellende Unternehmen das Produkt als EU-zertifiziertes Produkt an seine Kunden verkaufen.
EU-QPPV
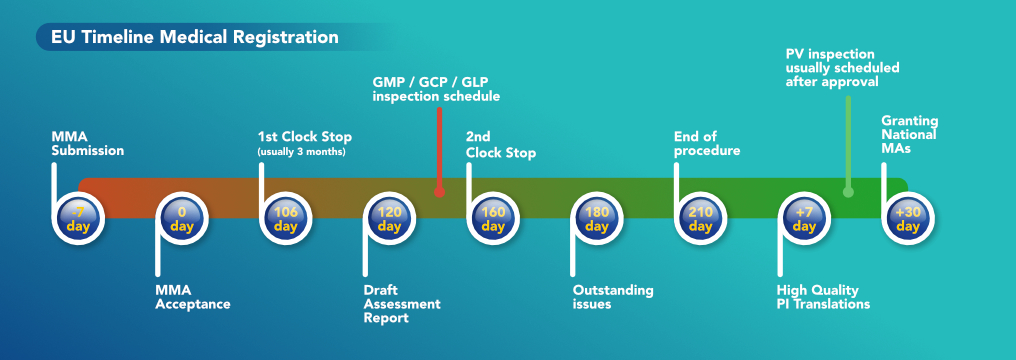
Die Europäische Union schreibt vor, dass jedes in der EU zugelassene Arzneimittel eine qualifizierte Person für Pharmakovigilanz in der Europäischen Union (EU-QPPV) haben muss. Die Pharmakovigilanz dient der Überwachung des Arzneimittels und der Meldung etwaiger unerwünschter Wirkungen, die beim Patienten auftreten könnten, wenn das Arzneimittel auf dem Markt ist. Die Angaben zur EU-QPPV müssen bei der ersten Einreichung des Dossiers ebenfalls enthalten sein; dies wird von der EU verlangt, da das Produkt in der EU registriert werden soll. Es gibt eine Reihe von Qualifikationen, über die man verfügen muss, um als EU-QPPV gelistet zu werden. So muss die EU-QPPV ihren Wohnsitz in einem EU-Land, Norwegen, Island oder Liechtenstein haben und im Besitz eines Hochschulabschlusses in Pharmazie, Humanmedizin, Tiermedizin, Chemie, pharmazeutischer Chemie und Technologie oder Biologie sein. Die EU-QPPV muss von jeder europäischen Behörde für die Arzneimittel, für die sie zuständig ist, kontaktiert werden können. Auch wenn das Medikament nicht auf dem EU-Markt ist, muss die EU-QPPV bei der anfänglichen Einreichung des Dossiers aufgeführt und das Medikament überwacht werden. EudraVigilance ist eine Plattform zur Registrierung von Arzneimitteln und zur Meldung/Bewertung von vermuteten unerwünschten Arzneimittelwirkungen der von Patienten eingenommenen Arzneimittel. Das Arzneimittel muss bei EudraVigilance registriert und dann mit der EU-QPPV verknüpft werden.
Ein Qualitätsmanagementsystem für die Pharmakovigilanz ist erforderlich und muss ständig auf dem neuesten Stand gehalten werden. Es ist eine Pharmakovigilanz-Stammdokumentation (PSMF) zu erstellen, in der das Pharmakovigilanzsystem erläutert wird, das der Inhaber der Genehmigung für das Inverkehrbringen verwendet. Diese muss sich an dem Ort befinden, an dem die EU-QPPV tätig ist oder an dem die Hauptaktivitäten der Pharmakovigilanz durchgeführt werden. Es liegt in der Verantwortung der EU-QPPV sicherzustellen, dass alle unerwünschten Arzneimittelwirkungen (Bsp.: ein Patient hat das Arzneimittel eingenommen und zeigt eine Nebenwirkung), Produktqualitätsbeschwerden (Bsp.: der Patient hat das Arzneimittel nicht injiziert, aber es gibt ein Problem, z. B. ein zerrissenes Etikett auf der Flasche) oder medizinische Anfragen (das sind alle Fragen zum Arzneimittel, die keine UAW oder PQCs sind, z. B. kann ich Orangensaft mit dem Arzneimittel trinken?) erfasst werden.
Die PQE Group kann all diese miteinander verknüpften Dienstleistungen und Anforderungen sowohl für regulierte als auch für nicht regulierte Märkte durch unseren Verbundpartner Quintian Pharma unterstützen. Quintian Pharma bietet der pharmazeutischen Industrie Dienstleistungen und Unterstützung unter Befolgung aller EU-Richtlinien für neue Produkte.