
Como resultado, uma árvore de decisão foi criada pelo Comitê de Medicamentos Veterinários (CVMP) com o objetivo de permitir que os reguladores conduzam uma avaliação de risco completa até janeiro de 2023, demonstrando conformidade com a Monografia Geral da Farmacopeia Europeia 2619, conforme visto abaixo.
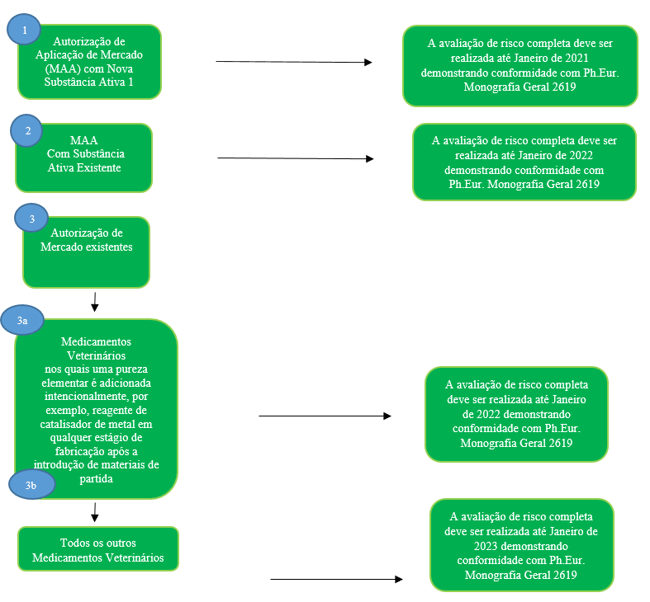
A árvore de decisão fornece uma abordagem de implementação em fases para os medicamentos veterinários que contêm:
- Substâncias químicas e biológicas/biotecnológicas
- Antibióticos sintéticos e semissintéticos
- Peptídeos sintéticos de baixo peso molecular
A árvore de decisão não se aplica a:
- Produtos fitoterápicos veterinários, radiofármacos, produtos imunológicos, medicamentos veterinários destinados à terapia genética, medicina regenerativa, engenharia de tecidos, terapia com hemoderivados e terapia fágica ou a elementos intencionalmente incluídos em um medicamento veterinário para benefício terapêutico.
Portanto, a questão é: quando é necessária uma avaliação de risco?
Uma avaliação de risco será necessária quando a identificação de potenciais impurezas elementares for encontrada. Essas impurezas podem ser derivadas de catalisadores e reagentes inorgânicos adicionados intencionalmente, ou que estão presentes involuntariamente em substâncias ativas e/ou excipientes, bem como provenientes do equipamento de fabricação ou da embalagem do medicamento.
Atualmente, existem três abordagens para construir a avaliação de risco:
- A abordagem do medicamento
- A abordagem de componentes
- A combinação das abordagens do medicamento e do componente
A estratégia de controle da avaliação de risco deve ser baseada em diretrizes de gerenciamento de risco de qualidade, mas para medicamentos veterinários, os princípios de identificação de risco, análise de risco e avaliação de risco podem ser usados para:
- Identificação de fontes conhecidas e potenciais de impurezas elementares que podem entrar no medicamento veterinário
- Avaliação da presença de uma determinada impureza elementar no medicamento veterinário, determinando o nível observado ou previsto da impureza e comparando-o com os limites de aceitação
- Resumo e documentação da avaliação de risco, que deve estar disponível no local de fabricação para revisão e inspeção
Com a Monografia Geral da Farmacopeia Europeia 2619 sendo atualizada em janeiro de 2023, mais orientações sobre as ações regulatórias esperadas serão explicadas e publicadas de forma mais completa. A PQE Group pode apoiar o seu negócio e garantir o cumprimento integral das novas diretrizes em medicamentos veterinários. Nosso portfólio de serviços garante uma solução abrangente para cobrir todas as suas necessidades usando nossa abordagem Glocal -- trabalhamos em nível local, mantendo uma mentalidade global. Nós oferecemos:
- Webinars e treinamentos para educar e reforçar sua força de trabalho sobre os novos conceitos do lançamento recente
- Suporte para integração de novos conceitos e metodologias em seu SGQ
- Workshops, avaliações e análise de gaps orientados para a preparação para a atualização do CVMP
- Elaboração de novos procedimentos e/ou atualização dos existentes
- Suporte na aplicação de novos conceitos à projetos pilotos, sistemas, equipamentos e infraestruturas
FONT: Agência Europeia de Medicamentos
REF: EMA/CVMP/QWP/631010/2017-REV2 - Comitê de Medicamentos para Uso Veterinário (CVMP)






