
Como resultado, el Comité de Medicamentos Veterinarios (CVMP) ha creado un árbol de decisiones con el objetivo de permitir a los reguladores realizar una evaluación de riesgos completa para enero de 2023, demostrando el cumplimiento de la Monografía General 2619 de la Farmacopea Europea, como se ve a continuación. Este proceso ha puesto el foco en la digitalización como la mejor solución para hacer frente a los nuevos volúmenes de producción y calidad. De hecho, los fabricantes están tratando de encontrar soluciones para automatizar sus sistemas de producción y manejo de datos, con el fin de reducir el impacto humano y sus posibles consecuencias negativas.
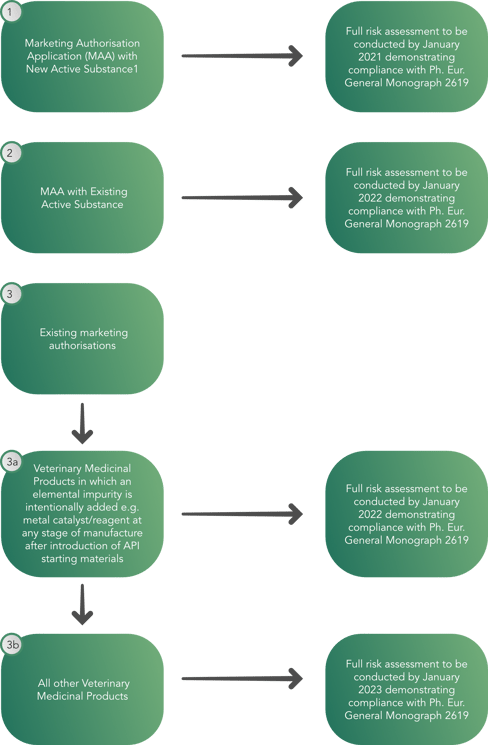
El árbol de decisiones proporciona un enfoque de aplicación por fases para los medicamentos veterinarios que contienen:
- Sustancias químicas y biológicas/biotecnológicas
- Antibióticos sintéticos y semisintéticos
- Péptidos sintéticos de bajo peso molecular
El árbol de decisiones no se aplica a:
- Productos veterinarios a base de plantas, radiofármacos, productos inmunológicos, medicamentos veterinarios diseñados para terapia génica, medicina regenerativa, ingeniería de tejidos, terapia con hemoderivados y terapia con fagos o a elementos que se incluyen intencionadamente en un medicamento veterinario para obtener un beneficio terapéutico.
Así que la pregunta es, ¿cuándo se requiere una evaluación de riesgos?
Se requerirá una evaluación de riesgos cuando se identifiquen posibles impurezas elementales. Estas impurezas pueden proceder de catalizadores y reactivos inorgánicos añadidos intencionadamente, o estar presentes de forma no intencionada en sustancias activas y/o excipientes, así como proceder del equipo de fabricación o del envase del medicamento.
Actualmente existen tres enfoques para construir la evaluación de riesgos:
- El enfoque del medicamento
- El enfoque de los componentes
- La combinación de los enfoques del medicamento y de los componentes
La estrategia de control de la evaluación de riesgos debe basarse en las directrices de gestión de riesgos para la calidad, pero para los medicamentos veterinarios pueden utilizarse los principios de identificación, análisis y evaluación de riesgos:
- Identificación de fuentes conocidas y potenciales de impurezas elementales que puedan introducirse en el medicamento veterinario.
- Evaluación de la presencia de una impureza elemental concreta en el medicamento veterinario determinando el nivel observado o previsto de la impureza y comparándolo con los límites de aceptación.
- Resumen y documentación de la evaluación de riesgos, que deberá estar disponible en el lugar de fabricación para su revisión e inspección.
Con la actualización de la Monografía General 2619 de la Farmacopea Europea en enero de 2023, se explicarán y publicarán más detalladamente las orientaciones sobre las medidas reglamentarias previstas. PQE Group puede proporcionar apoyo a su negocio y garantizar el pleno cumplimiento de las nuevas directrices en medicamentos veterinarios. Nuestra cartera de servicios garantiza una solución integral para cubrir todas sus necesidades utilizando nuestro enfoque Global -- trabajamos a nivel local manteniendo una mentalidad global. Ofrecemos:
-
Webinars y cursos de formación para formar a su personal en los nuevos conceptos de la última versión.
-
Apoyo para integrar nuevos conceptos y metodologías en su SGC
-
Talleres, evaluaciones y análisis de carencias orientados a preparar la actualización del CVMP
-
Redacción de nuevos procedimientos y/o actualización de los existentes
-
Apoyo para la aplicación de nuevos conceptos a proyectos (piloto), sistemas, equipos e infraestructuras reales
Fuente: European Medicines Agency
Referencias: EMA/CVMP/QWP/631010/2017-REV2 - Committee for Medicinal Products for Veterinary Use (CVMP)






