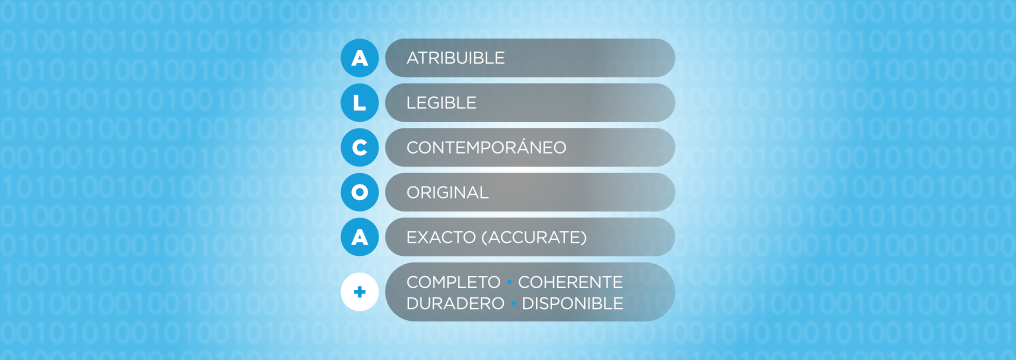
¿Qué debe hacer una empresa para cumplir los requisitos de Data Integrity?
Uno de los aspectos fundamentales para garantizar el cumplimiento es la sensibilización a través de la cultura de la empresa. Los empleados deben ser conscientes de la importancia de la integridad de los datos y todos los requerimientos de DI deben estar presentes en el Sistema de Gestión de Calidad (QMS, por sus siglas en ingles) de la empresa e integrados en todos los flujos de trabajo, incluidas las políticas, los SOP, la creación y gestión de documentación, la gestión de sistemas informatizados, el archivo y la formación.
La mejor herramienta que puede utilizar una empresa para mejorar su cultura de DI es un programa de formación bien construido para sus empleados, que incluya no sólo los requerimientos de DI, sino también las posibles consecuencias a las que podría enfrentarse la empresa si no los cumple. Gracias a esta herramienta, los empleados serán plenamente conscientes de los requerimientos y de la importancia de respetarlos y mantenerlos.
¿Qué debe incluir un programa de cumplimiento de Data Integrity?
Ciertamente, la base de un programa exhaustivo puede establecerse con el desarrollo de un plan de proyecto detallado, que defina el alcance del programa, las acciones a emprender y un calendario con fechas de vencimiento.
Dicho plan de proyecto debe tener en cuenta dos aspectos fundamentales:
-
Fase I, durante la cual se crea un análisis que confronta el QMS real con los requerimientos de DI e identifica una lista de gaps que deben cubrirse a través de un Plan de Acciones Correctivas y Preventivas (CAPA) dedicado. La implantación del Plan CAPA debe corresponderse con la creación de un "punto cero" o "punto de partida", a partir del cual todo lo que se implanta en el QMS ya cumpla los requerimientos de Integridad de Datos.
- Fase 2, en la que se desarrolla un programa para evaluar todo lo que ya estaba presente en la empresa antes de la implantación del Plan CAPA para garantizar que se cumplen plenamente los Requerimientos DI. Esta fase debe centrarse en la evaluación de los principales flujos de trabajo: papel, instrumentos y sistemas con impacto en las GMP, utilizados/instalados en diferentes áreas. El objetivo de la evaluación es identificar los gaps que pueden subsanarse mediante el Plan CAPA y dará lugar a un Plan de Corrección, que alineará todos los procesos existentes con los requerimientos de Data Integrity.
Esta estrategia garantiza que todo lo implantado desde el final de la Fase 1 cumplirá los requerimientos de DI, mientras que con la conclusión de la Fase 2, todo lo que ya estaba presente alcanzará el cumplimiento. El tiempo dedicado a la implantación de la Fase 1 contribuirá a que la Fase 2 sea más condensada, ya que se reducirá la lista de revisión de elementos que va en el plan de remediación.
Ambas fases se componen de:
Está claro que una implantación simultánea de ambas fases sería difícil de completar, y es fundamental establecer prioridades basadas en una evaluación de riesgos que produzca una lista jerárquica de ítems que incluya diferentes niveles de criticidad y fechas de vencimiento para cada acción, dando a cada una. plazos a corto, medio o largo plazo y creando un plan de remediación estructurado.
Durante la fase de implantación, la interacción entre la normativa DI y el QMS desempeña un papel clave, ya que debe garantizar:
- El cumplimiento de los plazos previstos en el plan del proyecto.
- La conformidad entre las acciones previstas y las ejecutadas.
¿Cómo se traduce en la práctica la interacción entre la acción planificada y la ejecutada?
El QMS debe gestionar el proceso para alcanzar la conformidad con la Normativa DI, trasladando todos los aspectos del proyecto a las herramientas de la empresa implicadas en la gestión de la calidad como CAPA, Control de Cambios y Compromiso, asegurando tres aspectos fundamentales:
- Trazabilidad
- Correct implementation of what has been identified during DI Assessment
- Continuous monitoring of all actions to implement
Estos tres aspectos, fundamentales para alcanzar el pleno cumplimiento, tienen la misma importancia que el conjunto de las fases de planificación y evaluación, por las razones que se exponen a continuación:
Trazabilidad:
Vinculación de las acciones creadas con lo que se ha identificado durante la Evaluación DI, rastreando cada cambio para garantizar que el proyecto es sólido y está preparado para posibles requerimientos o comprobaciones por parte de entidades regulatorias o clientes.
Implantación correcta:
Verificar que lo que se ha identificado durante la evaluación se implementa correctamente, teniendo siempre presente la solicitud inicial y cada cambio requerido y realizado (por ejemplo, revisar la evaluación DI para realizar cambios y asegurar la trazabilidad).
Seguimiento:
Asegurar que se cumplan todos los plazos, gestionar los posibles retrasos y garantizar la trazabilidad y la correcta implementación, son factores que juegan un papel fundamental para evitar la pérdida de esfuerzos y garantizar que la planta alcanza y mantiene el cumplimiento de la Normativa DI.
En Conclusión
En conclusión, el objetivo del Cumplimiento Data Integrity es garantizar que una planta cumple plenamente la Normativa de Integridad de los Datos. Este proceso debe construirse creando una cultura de empresa en la que todos los empleados sean conscientes de la naturaleza crítica de DI, estructurando un plan de gestión centrado en la integridad y supervisando el estado de avance de todo el proyecto para garantizar que la empresa alcanza este el estado de Cumplimiento.