Sistemas de farmacovigilancia en empresas farmacéuticas
La Farmacovigilancia se define como la "ciencia y actividades relacionadas con la detección, evaluación, comprensión y prevención de eventos adversos o cualquier otro problema relacionado con los medicamentos". Las empresas farmacéuticas, como Titulares de Autorizaciones de Comercialización, tienen obligaciones específicas al respecto, definidas por su respectivo marco legal. En particular, deberán disponer de un sistema de farmacovigilancia adecuado para recoger información sobre los medicamentos y diseñado para controlar la seguridad de los medicamentos autorizados y detectar cualquier modificación de su relación riesgo-beneficio. Además de una exigencia regulatoria, un buen sistema de farmacovigilancia representa una estrategia fundamental para garantizar la seguridad del paciente, mejorar la reputación de la empresa y guiar el desarrollo de terapias cada vez más seguras y eficaces.
Farmacovigilancia post-comercialización
El perfil de seguridad de un medicamento disponible en el mercado debe controlarse constantemente porque la población con la que entra en contacto es mucho más compleja que la muestra limitada de pacientes que se someten a ensayos clínicos previos a su comercialización. Entran en juego nuevas variables, como enfermedades preexistentes, interacciones farmacológicas en politerapias, factores genéticos y dietéticos, grupos especiales (mujeres embarazadas, niños, ancianos) y la duración de los tratamientos (por ejemplo, uso crónico), que pueden aportar nueva información sobre seguridad y eficacia (por ejemplo, reacciones adversas raras pero graves, riesgos potenciales, etc.).
Consideraciones económicas
Un dato importante que se desprende de esta investigación es que la Calidad por Diseño (QbD, por sus siglas en inglés) se ha practicado más en realidades de moléculas pequeñas que en biotecnología, lo que puede explicarse por la complejidad intrínseca de los diversos pasos de un producto biotecnológico. También se ha evidenciado que la mayoría de los productos biotecnológicos desarrollados con QbD han utilizado este enfoque durante el desarrollo de sustancias farmacológicas, una fase crítica y compleja que incluye pasos como el desarrollo de bancos de células maestras y de trabajo, y el proceso de fabricación y su escalado.
Otra preocupación importante de las empresas farmacéuticas en general proviene del coste de las actividades, principalmente porque la inversión debe realizarse en una fase temprana del proyecto, cuando aún se desconoce si el producto objetivo será realmente apto para el mercado y cuando aún no se dispone de datos de estudios clínicos.
Algunas incertidumbres y malentendidos sobre la definición del pilar de la QbD podrían ser la fuente de dificultades en la aplicación de este enfoque, especialmente en los primeros años en la UE. Por último, las ventajas regulatorias no están claras.
Un beneficio seguro de la aplicación de la norma de integración de la calidad en el producto sería evitar problemas cuando el proyecto se encuentre en una fase avanzada debido al uso de materiales que puedan afectar a la calidad del producto final.
Informes espontáneos
En la historia de la Farmacovigilancia, los profesionales sanitarios han sido los principales proveedores de informes de casos de sospechas de reacciones adversas. Sin embargo, la falta de notificación de reacciones adversas sigue siendo un problema importante. Para superar esta deficiencia y disponer de una cantidad razonable de datos de seguridad, las empresas farmacéuticas deberían contribuir a difundir la cultura de la notificación entre los profesionales sanitarios. De este modo, se destacaría el valor de la farmacovigilancia como parte integrante de las prácticas clínicas y se fomentaría una mayor concienciación sobre el papel fundamental de la industria en la mejora de la comprensión de las enfermedades y el uso más seguro de los medicamentos.
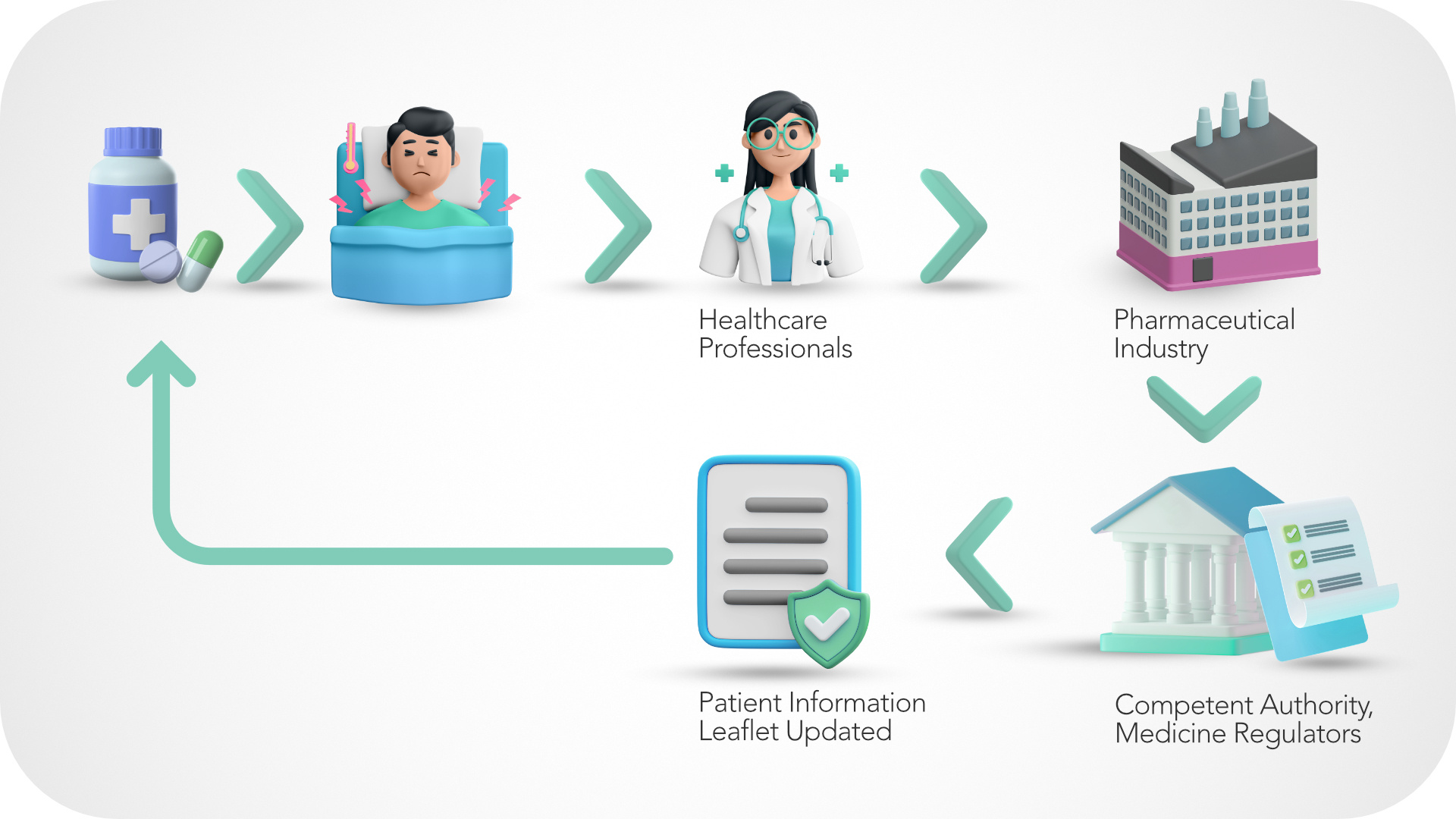
El papel central de los profesionales sanitarios en la Farmacovigilancia
En el imaginario colectivo, el profesional sanitario es la figura de referencia a la que acudimos cuando tenemos un problema de salud. Los profesionales sanitarios representan mucho más en la práctica clínica, ya que son la figura de conexión entre las empresas farmacéuticas, los centros nacionales de farmacovigilancia y los pacientes. Desempeñan un papel clave en la preservación de la salud pública, que es uno de los objetivos de la farmacovigilancia. Además, poseen los conocimientos, habilidades y preparación adecuados para identificar, reconocer, gestionar y prevenir las reacciones adversas a los medicamentos.
Fuentes:
- World Health Organization (WHO). The importance of pharmacovigilance: safety monitoring of medicinal products. Genève: WHO; 2002
- World Health Organization (WHO). The safety of medicines in public health programmes: pharmacovigilance an essential tool. Genève: WHO; 2006