
Aus diesem Grund wurde vom Ausschuss für Tierarzneimittel (CVMP) ein Entscheidungsbaum erstellt, der es den Regulierungsbehörden ermöglicht, bis Januar 2023 eine vollständige Risikobewertung durchzuführen und die Einhaltung der allgemeinen Monographie 2619 des Europäischen Arzneibuchs, wie unten dargestellt, nachzuweisen.
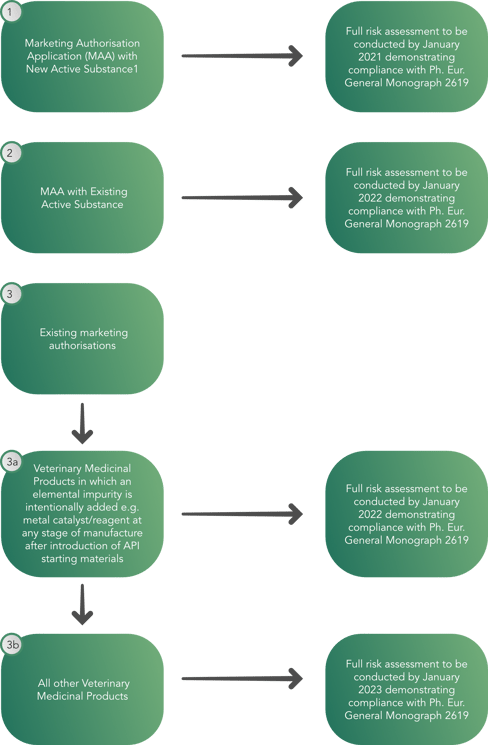
Der Entscheidungsbaum sieht für Tierarzneimittel eine schrittweise Umsetzung vor, die Folgendes enthält:
- Chemische und biologische/biotechnologische Substanzen
- Synthetische und halbsynthetische Antibiotika
- Synthetische Peptide mit niedrigem Molekulargewicht
Der Entscheidungsbaum gilt nicht für:
- Pflanzliche Tierarzneimittel, Radiopharmazeutika, immunologische Produkte, Tierarzneimittel für Gentherapie, Regenerative Medizin, Gewebezüchtung, Blutprodukttherapie und Phagentherapie oder für Elemente, die zum therapeutischen Nutzen absichtlich in einem Tierarzneimittel enthalten sind.
Die Frage lautet also: Wann ist eine Risikobewertung erforderlich?
Eine Risikobewertung ist erforderlich, wenn potenzielle elementare Verunreinigungen festgestellt werden. Diese Verunreinigungen können aus absichtlich hinzugefügten Katalysatoren und anorganischen Reagenzien stammen oder unbeabsichtigt in Wirkstoffen und/oder Hilfsstoffen enthalten sein. Zudem können sie aus Herstellungsanlagen oder der Verpackung des Arzneimittels stammen.
Es gibt derzeit drei Ansätze zur Erstellung der Risikobewertung:
- Arzneimittelansatz
- Komponentenansatz
- Kombination aus Arzneimittel- und Komponentenansatz
Die Kontrollstrategie der Risikobewertung sollte auf Leitlinien für das Qualitätsrisikomanagement basieren. Bei Tierarzneimitteln können jedoch die Grundsätze für die Risikoidentifizierung, Risikoanalyse und Risikobewertung für Folgendes verwendet werden:
- Identifizierung bekannter und potenzieller Quellen von elementaren Verunreinigungen, die in das Tierarzneimittel gelangen können
- Bewertung des Vorhandenseins einer bestimmten elementaren Verunreinigung im Tierarzneimittel durch Bestimmung des beobachteten oder vorhergesagten Verunreinigungsgrades und Vergleich mit den Akzeptanzgrenzen
- Zusammenfassung und Dokumentation der Risikobewertung, die im Produktionsbetrieb zur Überprüfung und Inspektion zur Verfügung stehen sollte
Durch die Aktualisierung der allgemeinen Monographie 2619 des Europäischen Arzneibuchs im Januar 2023 werden weitere Leitlinien zu den erwarteten regulatorischen Maßnahmen genauer erläutert und veröffentlicht werden. Die PQE Group kann Ihr Unternehmen unterstützen und sicherstellen, dass die neuen Richtlinien für Tierarzneimittel vollständig eingehalten werden. Unser Dienstleistungsportfolio garantiert mit seinem „Glocal“-Ansatz eine umfassende Lösung, die alle Ihre Bedürfnisse abdeckt. Das heißt, wir arbeiten auf lokaler Ebene, aber mit einer globalen Denkweise. Wir bieten:
- Webinare und Schulungen, um Ihre Mitarbeiter über die neuen Konzepte der jüngsten Veröffentlichung aufzuklären
- Unterstützung bei der Integration neuer Konzepte und Methoden in Ihr QMS
- Workshops, Bewertungen und Lückenanalyse zur Vorbereitung auf die Aktualisierung durch das CVMP
- Verfassen neuer Verfahrensanweisungen und/oder Aktualisierung bestehender
- Unterstützung bei der Anwendung neuer Konzepte in realen (Pilot-) Projekten, Systemen, Anlagen und Infrastrukturen
Literaturhinweise
- Implementation of risk assessment requirements to control elemental impurities in veterinary medicinal products (EMA/CVMP/QWP/631010/2017-Rev.2).
- ICH-Richtlinie Q3D zu elementaren Verunreinigungen (EMA/CHMP/ICH/353369/2013).
- ICH-Leitlinie Q9 zum Qualitätsrisikomanagement (EMA/CHMP/ICH/24235/2006).
- Europäisches Arzneibuch, allgemeine Monographie 2619: Pharmazeutische Präparate.



