Quality by Design – есть у валидации начало, нет у валидации конца
Слоган выше, характеризующий валидацию, зачастую на различных конференциях произносят по-философски с некоторым налётом грусти. До недавнего времени – без «диковинного» словосочетания «Quality by Design» – «качество через дизайн». Но в связи с вступлением силу обновленного Приложения 15 GMP ЕАЭС (в форме Решения Совета Евразийской экономической комиссии от 14 июля 2021 г. № 65 «О внесении изменений в Правила надлежащей производственной практики Евразийского экономического союза») к этим тяжким раздумьям добавилось и новое понятие, хотя новизной является только его официально закрепленная возможность применения. Вместе с тем, если пойти немного вглубь, то в рамках ЕАЭС концепция «качество через дизайн» впервые прозвучала в тексте Рекомендации Коллегии Евразийской экономической комиссии от 26 сентября 2017 г. № 19 «О Руководстве по валидации процесса производства лекарственных препаратов для медицинского применения». Не говоря уже о том, что и Решение № 65 (соответствующее в целом приложению 1 5 GMP EU) и Рекомендация № 19 (соответствующее в целом Руководству ЕМА по валидации процесса) всего лишь актуализируют достаточно давно прорабатываемый концепт, сменяющий подход «Quality by Testing», как неприемлемый в виду запредельной контрпродуктивности. Делая акцент на тестирование готовой продукции, мы пытались компенсировать отсутствие знаний о продукте и процессе, что приводило к значительному риску производства некачественного продукта и убыткам для компании.
Что же скрывается за словосочетанием «качество через дизайн» (Quality by Design), которое теперь предложено к рассмотрению? Оттолкнемся от определения, данного по текстам Решения 65 и Рекомендации № 19 – это системный подход, предусматривающий определение целей перед началом разработки продукции, точную оценку продукции и процесса ее производства, а также контроль процесса производства на основе научных данных и принципов управления рисками для качества.
Звучит это всё как «пугающее наукообразие». Мало того, что валидация процесса на современном этапе перестает быть разовым событием – уже исключен вариант произвести «коекак» три валидационные серии и «забыть» о валидации на какое-то время – так вдобавок ещё и предлагается осуществлять контроль процесса производства на основе научных подходов. Таким образом, наукоёмкость и ресурсоемкость процесса очевидно возрастают. При этом не следует забывать, что если подход «качество через дизайн» является в настоящее время допустимой альтернативой, то продолжающаяся верификация процесса в ходе жизненного цикла становится безальтернативным обязательством.
Казалось бы, эти нововведения могут восприниматься как очередной «регуляторный прессинг», «гиря на ногах бизнеса». Однако при более детальном рассмотрении выясняется, что как раз реализация концепта «качество через дизайн» способна сократить затраты по выведению на рынок новых лекарственных препаратов вплоть до 25%. За счет чего может быть достигнут такой эффект? По сравнению с традиционным подходом (когда этап фарм– разработки выполнялся без должного статистического обоснования, во многом эмпирическим путем, «по наитию»), больший фокус внимания уделяется именно этапу фармацевтической разработки – именно там формируется целевой профиль продукта, а также связанные с ним CQA (критические показатели качества), CPP (критические параметры процесса), как возможная опция – пространство проектных параметров (Design Space) и стратегия контроля. Считается, что реализация такого концепта не принесёт какой-то значимой экономии на этапе фармразработки, однако обеспечит статистически обоснованные знания о продукте и процессе, что заметно упростит масштабирование, трансфер и производство последующих коммерческих серий, поскольку процесс будет заведомо в состоянии статистического контроля (см. рис. 1).
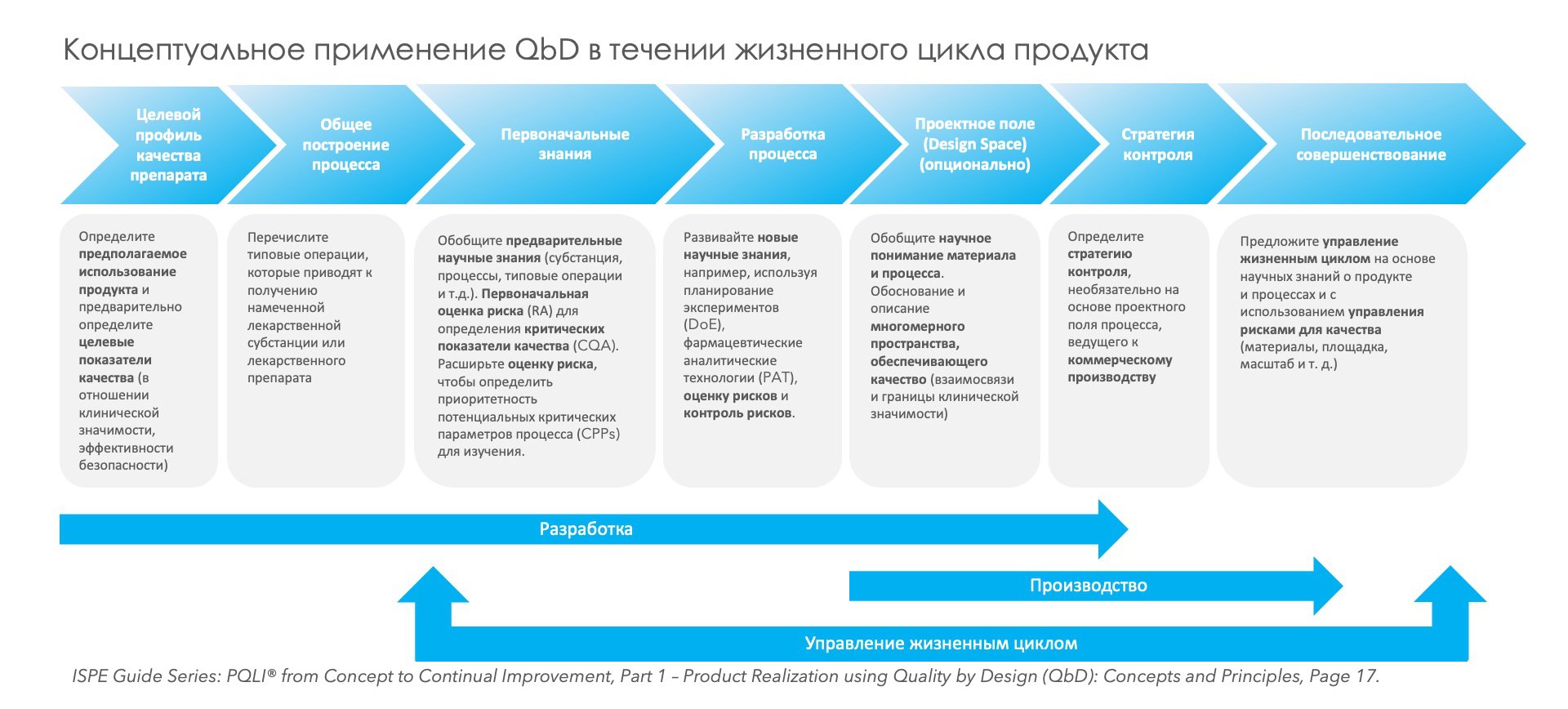 Рис. 1. Обзор концепта «качество через дизайн»
Рис. 1. Обзор концепта «качество через дизайн»
Полная версия статьи доступна на сайте NPJ NEWS