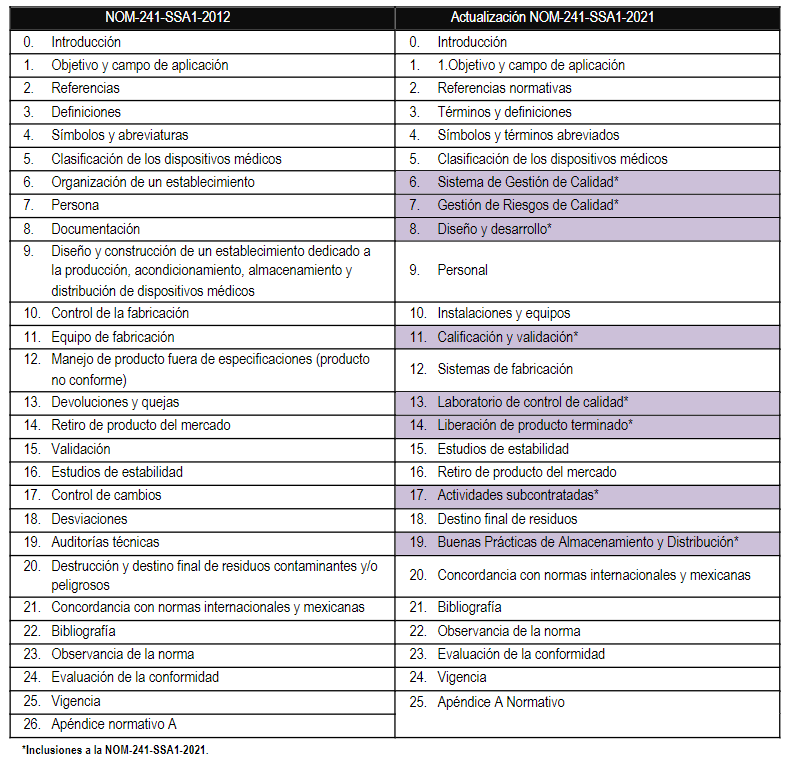
Asimismo, se reconocerá como equivalente al Sistema de Gestión de Calidad requerido por la NOM-241-SSA1 vigente, la certificación bajo el estándar ISO13485 vigente, emitida por organismos autorizados por las entidades de acreditación nacionales o las reconocidas internacionalmente en la evaluación de la conformidad, por lo que la inspección de los establecimientos se efectuará bajo un enfoque reducido exceptuando el Capítulo 6 y sus incisos.
Definición de Dispositivo Médico.
La actualización de la NOM-241-SSA1 define como Dispositivos Médicos, al instrumento, aparato, utensilio, máquina, software, producto o material implantable, agente de diagnóstico, material, sustancia o producto similar, para ser empleado, solo o en combinación, directa o indirectamente en seres humanos; con alguna(s) de las siguientes finalidades de uso, lo cual asegura una correcta categorización y clasificación de los mismos:
— Diagnóstico, prevención, vigilancia o monitoreo, y/o auxiliar en el tratamiento de enfermedades;
— Diagnóstico, vigilancia o monitoreo, tratamiento, protección, absorción, drenaje, o auxiliar en la cicatrización de una lesión;
— Sustitución, modificación o apoyo de la anatomía o de un proceso fisiológico;
— Soporte de vida;
— Control de la concepción;
— Desinfección de dispositivos médicos;
— Sustancias desinfectantes;
— Provisión de información mediante un examen in vitro de muestras extraídas del cuerpo humano, con fines diagnósticos;
— Dispositivos que incorporan tejidos de origen animal y/o humano, y/o
— Dispositivos empleados en fertilización in vitro y tecnologías de reproducción asistida;
y cuya finalidad de uso principal no es a través de mecanismos farmacológicos, inmunológicos o metabólicos, sin embargo, pueden ser asistidos por estos medios para lograr su función. Los dispositivos médicos incluyen a los Insumos para la salud de las siguientes categorías: equipo médico, prótesis, órtesis, ayudas funcionales, agentes de diagnóstico, insumos de uso odontológico, materiales quirúrgicos, de curación y productos higiénicos.
Desarrollo y diseño de los Dispositivos Médicos.
Con respecto al proceso de desarrollo y diseño de los dispositivos médicos, la actualización de la NOM establece que es competencia del responsable del área de desarrollo el documentar los procedimientos correspondientes. Las fases implicadas que deben cubrirse en el Diseño y Desarrollo son:
— Diseño y planificación del desarrollo
— Entradas de diseño y desarrollo
— Productos del diseño y desarrollo
— Revisión del diseño y desarrollo
— Verificación del diseño y desarrollo
— Validación del diseño y desarrollo
— Transferencia del diseño y desarrollo
— Control de cambios en el diseño y desarrollo
— Expediente del diseño y desarrollo
En conclusión
Todas las actualizaciones descritas previamente tienen como finalidad lograr la armonización de la regulación sanitaria mexicana con la normatividad internacional, validando e incluso tomando aspectos importantes de la norma internacional ISO 13485:2016 para el sistema de gestión de calidad de dispositivos médicos, y para la regulación en las Buenas Prácticas de Almacenamiento y Distribución, lo cual representa el mayor reto para México, quien cuenta con un gran número de establecimientos que solo se dedican a la importación y distribución de dispositivos médicos, por lo que la actualización de la norma detalla los requisitos deben ser implementados correctamente, asegurando así el cumplimiento consistente de todo el proceso para garantizar la calidad, seguridad y funcionalidad de los dispositivos médicos de interés, previniendo así sanciones que pongan en riesgo a la organización